ЭХИНОКОККОЗ: СОВРЕМЕННЫЙ ВЗГЛЯД НА СОСТОЯНИЕ ПРОБЛЕМЫ (ЛЕКЦИЯ)
(АННАЛЫ ХИРУРГИЧЕСКОЙ ГЕПАТОЛОГИИ, 2006, том 11, № 1)
П.С.
Ветшев, Г.Х. Мусаев
Клиника
факультетской хирургии им. Н.Н. Бурденко (директор – академик РАМН А.Ф.
Черноусов) ММАА им. И.М. Сеченова
Hydatidosis: the
Modern Point of View
P.S. Vetshev, G.Kh. Musaev
N.N. Burdenko
Faculty Surgery Clinic (chief – academician RAMSci A.F. Chernousov) Moskow
Medical Academy
Пусть
люди критикуют и порицают нашу книгу,
лишь
бы они внимательно и вдумчиво прочли то, что в ней написано.
Френсис
Бэкон
В сентябре 2005 г. в Ташкенте состоялся очередной Международный конгресс хирургов гепатологов стран СНГ. Участие большого числа известных ученых и квалифицированных специалистов России и стран СНГ в сочетании с блестящей организацией, радушием и гостеприимством принимающей стороны, вероятно, стали основой за интересованного и высоконаучного обсуждения различных аспектов гепатобилиарной хирургии.
Одно из заседаний конгресса было
посвящено проблемам диагностики и лечения эхинококкоза – весьма актуальным и,
согласно прозвучавшим докладам, еще далеким от окончательного решения. Настоящая
статья, навеянная выступлениями ведущих специалистов и последующим обсуждением,
содержит и, казалось бы, уже устоявшиеся истины, и некоторые спорные и нерешенные
проблемы. При этом мы постарались выделить наиболее острые вопросы, вызвавшие наибольший
интерес и оживленную дискуссию на конгрессе (далее выделены шрифтом).
Эхинококкозы – актуальная проблема медицинской
паразитологии. Ларвальные (от лат.larva – личинка) эхинококкозы (альвеолярный и
гидатидозный) являются одними из наиболее опасных зооантропогельминтозов. Эти
заболевания характеризуются длительным хроническим течением, тяжелыми органными
и системными нарушениями, обширностью поражения, приводящими к инвалидности и
нередко – к гибели больного. С момента заражения до времени установления
диагноза латентный период продолжается от 5 до 20 лет (описан латентный период
эхинококковой кисты до 75 лет).
Возбудителем эхинококкоза, как известно,
является цепень Echinococcus granulosus, который паразитирует у плотоядных
животных. Промежуточные хозяева паразита – человек и сельскохозяйственные
животные. При этом человека можно рассматривать в качестве своеобразного биологического
тупика в развитии паразита. Из зародыша эхинококка медленно развивается
материнская киста, представляющая собой пузырь, заполненный жидкостью.
Стенка эхинококковой кисты
состоит из двух оболочек: наружной кутикулярной (хитиновой) и
внутренней герминативной (зародышевой). Кутикулярная оболочка является
продуктом экскреции клеток герминативной оболочки и близка по химической
природе к хитину насекомых. Оболочка непроницаема для микрофлоры, белков
хозяина, резистентна к нагноению и несет функцию полупроницаемой мембраны,
обеспечивая доступ к паразиту низкомолекулярных питательных веществ и предохраняя
клетки герминативной оболочки от воздействия неблагоприятных факторов хозяина.
Герминативная оболочка, осуществляющая все жизненные функции паразита,
разделена на три зоны: пристеночную – камбиальную, среднюю – зону известковых
телец и внутреннюю – зону выводковых капсул с формирующимися протосколексами и
ацефалоцистами (см.ниже: зародышевые элементы эхинококка). Учитывая, что кутикулярная
и герминативная оболочки макроскопически представлены единым образованием, в
литературе их часто объединяют в понятие “хитиновая оболочка”. Снаружи эхинококковая
киста окружена плотной соединительнотканной фиброзной капсулой, образующейся в
результате защитных реакций промежуточного хозяина против продуктов метаболизма
паразита и несущей своеобразную скелетную и защитную функции, предохраняя
паразита от механических повреждений, и непрекращающейся на всем протяжении
инвазии “иммунной атаки” хозяина.
После разрыва или перфорации материнской
кисты зародышевые элементы продолжают развитие с образованием вторичных
эхинококковых кист в просвете материнской или за ее пределами (экзогенных или
эндогенных эхинококковых кист). Экзогенные кисты встречаются очень редко.
Наличие дочерних и внучатых кист свидетельствует о высокой плодоносности личинки
эхинококка.
Высокая частота эхинококкоза преимущественно
в регионах с развитием животноводства связана с низким уровнем социально-экономического
развития и санитарной культуры населения. В экономически развитых странах рост
заболеваемости в основном обусловлен иммиграцией и развитием туризма. Именно в
этих регионах, равно как и в неэндемичных очагах, врачи часто не готовы к своевременной
диагностике и адекватному лечению больных эхинококкозом.
Инструментальная и лабораторная
диагностика заболевания нередко представляет трудную задачу, что связано с
его бессимптомным течением, особенно в раннем периоде развития, при
расположении кисты в глубине органа. При этом больные, как правило, обращаются
за медицинской помощью, когда паразитарная киста достигает значительных размеров,
или появляются такие осложнения, как нагноение кисты, прорыв в желчные пути,
брюшную или плевральную полости, бронхи и т.д. Все это выдвигает на первый план
диагностики инструментальные методы исследования, наиболее распространенным и
ведущим из которых является УЗИ. Метод позволяет диагностировать эхинококкоз в
стадии, когда паразитарные кисты имеют не большие размеры (порядка 10–30 мм),
что дает возможность чаще выполнять органосохраняющие вмешательства.
Современные ультразвуковые аппараты обладают
высокой разрешающей способностью, цветовым допплеровским картированием и возможностью
трехмерной реконструкции изображения. Это позволяет специалистам выявить саму кисту,
так называемое гипоэхогенное (анэхогенное) образование, “хитиновую оболочку” –
гиперэхогенную структуру, на внутренней поверхности которой нередко
определяются множественные гиперэхогенные включения – “гидатидный песок”
(зародышевые элементы эхинококка – протосколексы и ацефалоцисты).
Фиброзная капсула представлена гиперэхогенным ободком и разделена от хитиновой оболочки гипоэхогенным слоем, представляющим собой лимфатическую “щель” (рис. 1).
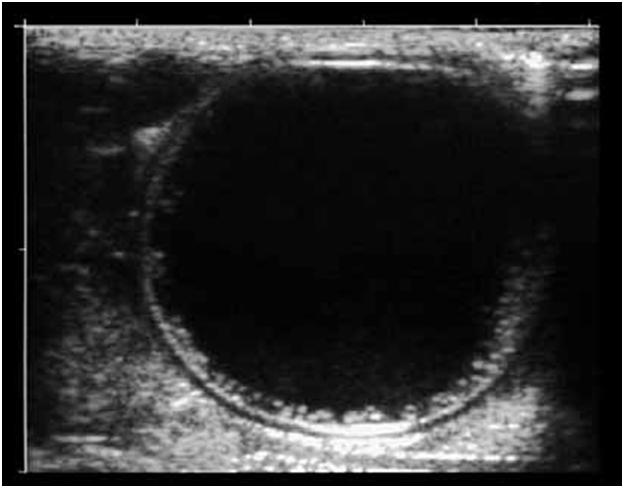
Рис. 1. Ультразвуковая сканограмма. Эхинококковая киста печени. Определяется анэхогенное образование с базальным усилением, гипоэхогенным ободком и четким двухконтурным строением стенки.
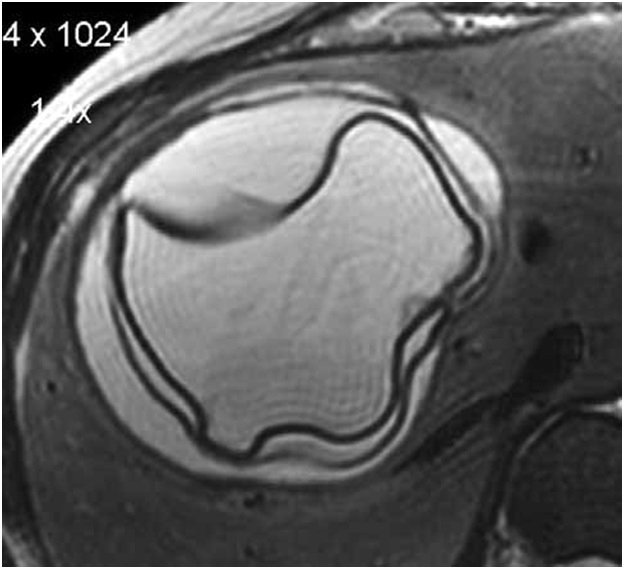
Ленточная гиперэхогенная структура в просвете кисты (отслоившаяся хитиновая оболочка), как и дополнительные кистозные включения (дочерние кисты), патогномоничны только для эхинококковых кист (рис. 2).
а
б
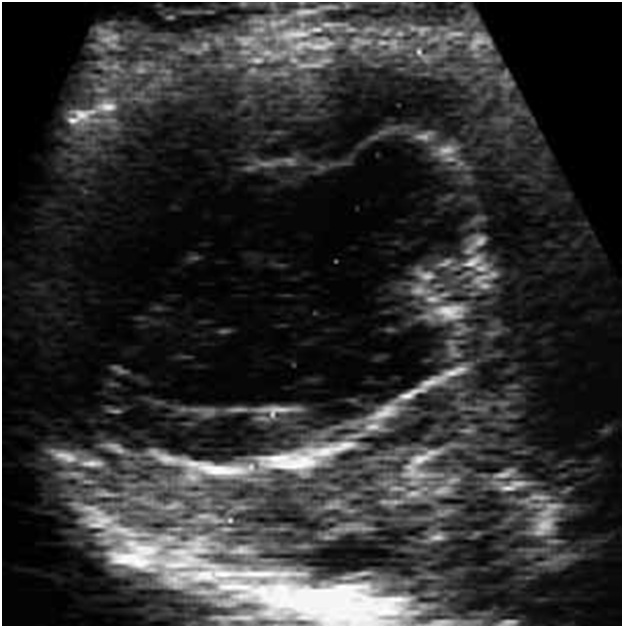
Рис. 2. Магнитно-резонансная
томограмма (а) и ультразвуковая сканограмма (б). Эхинококковые кисты. Определяются
ленточные гиперэхогенные структуры (обозначены стрелками) в просвете кисты –
отслоившаяся хитиновая оболочка.
Диагноз эхинококкоза правомочен при сочетании двух-трех и более указанных признаков.
В литературе, к сожалению,
существует устойчивое мнение о том, что наиболее характерным для эхинококковой
кисты следует считать наличие множества перегородок в просвете. Но, как
известно, биологические характеристики паразита таковы, что никакие элементы
хозяина (например, человека) в кисту проникать не должны. Иначе произойдет его
гибель. Поэтому формирование каких-либо перегородок в просвете кисты
невозможно, а сам этот термин представляется абсолютно неправомочным. При
наличии истинных перегородок в просвете кисты последнюю следует трактовать как
непаразитарную. В случае эхинококковой кисты выявляют либо погибшую материнскую
кисту с множеством дочерних и внучатых, но их легко дифференцировать от
перегородок, либо речь идет о множественном эхинококкозе, при этом кисты
расположены рядом и в процессе роста вызывают атрофию расположенной между ними
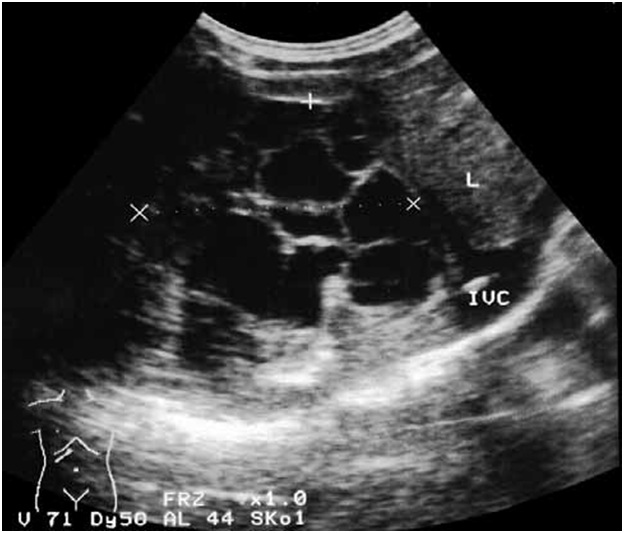
паренхимы печени (рис. 3), создающую эффект “перегородок”.
а
б
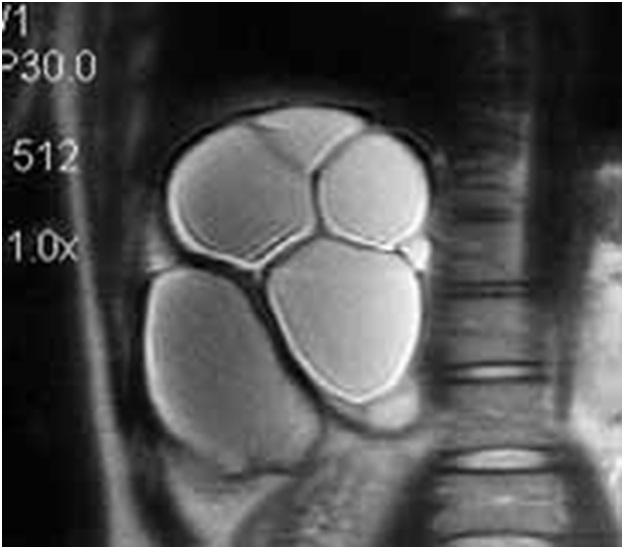
Рис. 3. Ультразвуковая
сканограмма (а) и магнитно-резонансная томограмма (б). Множественные рядом
расположенные эхинококковые кисты печени.
Следует подчеркнуть, что указание в протоколе исследования подробной характеристики кисты чрезвычайно важно для выбора оптимального метода лечения: одно дело, когда планируется операция по поводу солитарной эхинококковой кисты с множественны ми дочерними, и совершенно другое, когда планируется вмешательство по поводу множественных, пусть даже и рядом расположенных кист. Такие кисты не имеют общей фиброзной капсулы. Это может привести к тому, что во время операции киста не будет выявлена и оставлена в паренхиме органа (резидуальный эхинококкоз). К тому же каждая, так называемая перегородка обычно несет в себе сосуд и желчный проток.
При размерах кисты до 30–40 мм (чаще свидетельство ее молодого возраста) эти признаки слабо выражены, что чрезвычайно затрудняет дифференциальную диагностику. При небольших кистах более информативна магнитно-резонансная томография (МРТ), позволяющая в большинстве наблюдений выявить описанные выше характеристики паразитарной кисты (рис. 4).
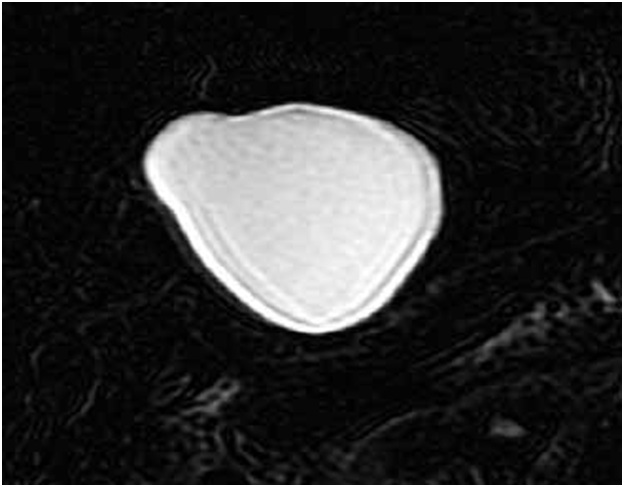
Рис. 4. Магнитно-резонансная томограмма. Эхинококковая киста малых размеров. Хорошо определяется “двойной” контур строения стенки кисты.
Лабораторные методы исследования при эхинококкозе не являются специфичными и позволяют получить лишь вспомогательную информацию для уточнения диагноза. В первую очередь это относится к эозинофилии, выявляемой в 18–83% наблюдений. Некоторые авторы отмечают характерное для больных эхинококкозом повышение числа лейкоцитов, общего белка плазмы крови. Количество лимфоцитов крови обычно снижено, все классы иммуноглобулинов крови чаще повышены.
Иммунологические методы в
диагностике эхинококкоза имеют большое, едва ли не решающее значение.
Распространенная до последнего времени реакция Casoni потеряла свою актуальность
в связи с малой информативностью и побочными, порой достаточно тяжелыми анафилактическими
реакциями. Наиболее информативными в последние годы считают реакции латекс-агглютинации
(РЛА), непрямой гемагглютинации (РНГА), иммуноферментного анализа (РИФА,
ELIZA), антительных единиц (АЕ). Они практически не имеют противопоказаний
и применимы для выявления эхинококкозов и рецидивов заболевания посредством их
неоднократного проведения. При одновременном использовании нескольких
иммунологических тестов диагностическая эффективность их превышает 90%, что
подтверждает и опыт нашей клиники.
Трудности дифференциальной диагностики, в
особенности при малых размерах кист и ложноотрицательных показателях
серологических реакций, диктуют потребность в получении материала для
морфологического подтверждения диагноза. Однако чрескожные
диагностические пункции при подозрении на эхинококкоз вплоть до последних лет
считались противопоказанными в связи с опасностью обсеменения зародышевыми элементами
паразита раневого канала иглы и брюшной полости. Лишь появление
специального инструментария и разработка техники выполнения чрескожной пункции,
предотвращающей развитие осложнений, позволили широко внедрить чрескожные
вмешательства для диагностики, а в последующем и лечения больных эхинококкозом.
В настоящее время в мире на коплен достаточно большой опыт чрескожных вмешательств
при эхинококкозе, достигающий у некоторых авторов более 500 наблюдений. Однако
при кажущейся простоте чрескожные пункции при отсутствии опыта и специального оборудования
все-таки чреваты серьезными интра- и послеоперационными осложнениями, вплоть до
летального исхода во время манипуляции. В медицинской литературе описаны тяжелые
анафилактические реакции и даже несколько летальных исходов при пункции
эхинококковых кист. Справедливости ради следует отметить, что сами авторы
признают, что осложнения и летальные исходы были обусловлены несоблюдением ими
техники вмешательства.
В настоящее время признана целесообразность
использования прицельной чрескожной пункции эхинококковых кист. Такие миниинвазивные
технологии следует применять в специализированных лечебных учреждениях при необходимости
дифференциальной диагностики. Доказана их безопасность при квалифицированном выполнении
манипуляции с тщательным соблюдением методики [1, 2].
Выявление паразитарной кисты в большинстве
наблюдений является показанием к оперативному вмешательству (за исключением
кист малых размеров – до 30 мм в диаметре). Наиболее распространенным методом
лечения больных эхинококкозом является хирургическое вмешательство. При этом
зачастую риск самой операции выше ожидаемого лечебного эффекта.
Указанное обстоятельство послужило в
последние годы основным стимулом к разработке щадящих, органосохраняющих
методов лечения в хирургии эхинококкоза. Этот вопрос на конгрессе был вынесен
отдельным пунктом, что и послужило основанием для обмена мнениями.
Много спорных и неоднозначных суждений вызывает
целесообразность миниинвазивных технологий. К настоящему времени, помимо
традиционных операций, все более широкое применение в клинической практике
получают следующие миниинвазивные вмешательства: лапароскопические, чрескожные
и операции из мини-доступа.
Лапароскопические методы применимы только
при экстрапаренхиматозной (хотя бы частичной) локализации кисты, при этом
вмешательство в задних сегментах печени представляет значительные трудности.
Перспективными представляются операции из мини-доступа.
Еще раз подчеркнем, что последние два
метода требуют экстрапаренхиматозной локализации и расположения кист на
передненижних поверхностях печени. При этом обязательным, по опыту нашей клиники,
является дооперационная пункция и противопаразитарная обработка кист, что
позволяет выполнить вмешательство на уже погибшей кисте и полностью исключить
риск обсеменения во время операции.
Чрескожные вмешательства более универсальны
и наиболее перспективны. Они же вызывают и наибольшие споры, а иногда и
откровенные укоры в невозможности выполнения эхинококкэктомии через
установленные тонкие дренажи, хотя с этим положением трудно согласиться.
Применение миниинвазивных технологий позволяет
повысить эффективность лечения у наиболее тяжелой категории больных с сочетанным
эхинококкозом легких, печени, селезенки, сердца, головного мозга. Комплексный
подход с применением рационального сочетания миниинвазивных операций у этой
группы больных еще более оправдан, поскольку позволяет в большинстве наблюдений
избежать комбинированных операций, сопряженных с высокой травматичностью.
Учитывая, что наша клиника стояла у
истоков разработки щадящих методов лечения паразитарных кист, более подробное
описание методики и хирургических аспектов лечения эхинококкоза представлено в
более ранних публикациях [3–6]. Большое внимание на конгрессе было уделено использованию
интраоперационных гермицидов при эхинококкозе печени как одному из решающих факторов
в профилактике рецидива заболевания. Было отмечено, что, несмотря на
усовершенствование методик вмешательства, соблюдение правил абластичности
выполнения операции, внедрение различных химических и физических методов воздействия
на паразита, частота рецидивов заболевания у некоторых авторов достигает 12–33%.
Оперативные вмешательства, выполняемые повторно при рецидиве заболевания, еще более
травматичны. Более того, практически у каждого второго больного этой группы в
после дующем вновь выявляют эхинококковые кисты.
Эти обстоятельства обусловили необходимость
проведения в рамках нашей клиники и Института медицинской паразитологии и тропической
медицины им. Е.И. Марциновского широкомасштабных экспериментальных исследований
с целью выяснения причин возникновения рецидивов заболевания [7].
Важно подчеркнуть, что описаны два
вида зародышевых элементов эхинококковой кисты – протосколексы и
ацефалоцисты. Протосколексам придавали основное значение при рецидиве заболевания,
а по степени воздействия на них определяли эффективность гермицидов. Вероятно,
это было обусловлено тем, что зародышевые элементы кисты преимущественно
представлены протосколексами и последние легко могут быть выявлены при
микроскопии. Ацефалоцисты в кисте обычно представлены единичными экземплярами,
их часто не выявляют, и роль их до последнего времени оставалась неясной.
В ходе экспериментальных исследований было
выяснено, что протосколексы эхинококка погибают практически на первой минуте
воздействия химических агентов. Ацефалоцисты, которым до последнего времени не
придавали должного значения, напротив, оказались чрезвычайно устойчивыми. Более
того, общепринятые в хирургии эхинококкоза гермициды – формалин и 10–20%
гипертонические растворы хлорида натрия оказались малоэффективными, так как не
приводили к гибели ацефалоцист даже при экспозиции 10–15 мин. Увеличение же времени
экспозиции (в особенности при применении формалина) повышало токсическое действие
препарата на организм человека.
Последующие исследования показали, что в
подавляющем большинстве наблюдений именно ацефалоцисты приводят к рецидиву
заболевания после хирургических вмешательств. Более того, впервые была
установлена возможность массового формирования микроскопических ацефалоцист из
герминативных клеток “ножки” протосколекса по типу альвеококка. Это означало,
что при определенных условиях число ацефалоцист в кисте возрастало, что весьма
опасно, так как паразит становится более “агрессивным” и устойчивым к
воздействию гермицидов, а риск рецидива после лечения повышается. Впервые у
человека была выявлена также способность кисты к инфильтративному росту, хотя и
менее выраженному, чем при альвеококкозе [7].
В литературе имеются единичные работы, в
которых авторы высказывают возможность проникновения зародышевых элементов
эхинококка за пределы хитиновой оболочки и даже фиброзной капсулы кисты. Выход
последних за пределы хитиновой оболочки не сказывается на результатах лечения
больных и не увеличивает риск рецидива, так как именно полость фиброз ной
капсулы должна подвергаться обработке гермицидами после удаления гидатидной жидкости
и хитиновой оболочки. Убедительных доказательств выхода зародышевых элементов
эхинококка за пределы фиброзной капсулы, что оправдывало бы применение
радикальной перицистэктомии и резекции органа, пока нет.
Об этом же свидетельствуют и результаты
большинства клиник, занимающихся лечением больных эхинококкозом. На большом
клиническом материале показано, что частота рецидива одинакова как при закрытой
простой эхинококкэктомии, так и при выполнении перицистэктомии и резекции
органа. Следует полагать, что если феномен выхода зародышевых элементов за пределы
фиброзной капсулы и имеет место, то он ничтожно мал и не должен влиять на выбор
хирургической технологии.
Таким образом, было установлено, что
протосколексы являются наиболее уязвимым элементом паразита и не могут служить
критерием для выбора гермицидов. Для интраоперационной обработки гидатидных
кист необходимы высокоэффективные гермициды, губительные именно для ацефалоцист
эхинококка как наиболее устойчивого звена паразита и самого важного фактора в
возникновении послеоперационных рецидивов заболевания. Наиболее
надежными и пригодными для практического применения оказались 80–100% глицерин
и 30% раствор хлорида натрия. Однако применение 30% хлорида натрия сопряжено с возможностью
разведения его тканевой жидкостью больного до неэффективной концентрации.
Глицерин же активен даже при значительном разведении, что гарантирует большую
его надежность. По опыту клиники, совпадающему с международным, только
указанные гермициды оправданы при противопаразитарной обработке кист во время
операций по поводу эхинококкоза [4, 5]. Предпочтение отдаем глицерину.
Следует помнить, что применение эффективных
гермицидов, соблюдение правил абластичности во время операции, использование
совершенного инструментария полностью не исключают возможности рецидива
заболевания. Большое влияние на результаты лечения оказывает послеоперационная
противогельминтная терапия. Она необходима и для воздействия на отсевы
эхинококка малых размеров, еще не доступные современным методам диагностики.
Наиболее эффективным и общепринятым препаратом,
воздействующим на гидатидозный эхинококк, является албендазол (андазол,
эсказол, немозол, зентель). Однако в России препарат “приживается” на удивление
очень трудно, хирурги неохотно рекомендуют больным послеоперационное медикаментозное
лечение. Преобладает точка зрения о чрезвычайной токсичности препарата, что не
соответствует действительности. Вероятно, сказывается негативный опыт ранее
применявшегося мебендазола, эффективного только при очень высокой, фактически
токсичной дозировке. К настоящему времени в мире описано более 250 наблюдений,
когда даже у беременных применяли албендазол без каких-либо последствий для
матери и плода.
В последние годы препарат также находит
все более широкое применение и в качестве самостоятельного метода лечения
при кистах размерами до 30 мм, особенно при легочной форме эхинококкоза.
Неоспоримым свидетельством в пользу противогельминтной терапии является тот
факт, что при сравнительном анализе опыта большинства ведущих специалистов она
практически сводит к минимуму (менее 1%) риск рецидива заболевания при условии
соблюдения правил оперирования и удаления всех выявленных кист.
Отдельного обсуждения всегда требует проблема
резидуального эхинококкоза. Не всегда возможно установить точную
грань между рецидивом и резидуальной кистой. Это влечет за собой и
противоречивые данные результатов лечения у разных авторов. При этом общепринято,
что под резидуальным следует понимать не диагностированные до операции или вынужденно
оставленные хирургами во время операции кисты. По нашему мнению, главная проблема
резидуального эхинококкоза заключается в использовании недостаточно информативных
методов диагностики и несоблюдении современного протокола обследования больного.
Решение же этой проблемы видится в тщательном соблюдении алгоритма обследования,
применении высокоинформативных методов диагностики (УЗИ, КТ, МРТ), сочетанном
использовании у одного больного традиционных и миниинвазивных методик и
обязательном применении интраоперационного УЗИ. Однако следует признать, что
достоверных критериев, позволяющих различить резидуальную кисту, рецидив или
повторное заражение, не существует. Использование временных критериев
повторного выявления кист недостоверно, так как между заражением и клинической
манифестацией может пройти 1 год или 20 лет (описан наиболее длительный срок 40
лет). Вероятность же повторного заражения после успешного лечения ничтожна и, по
многочисленным данным клиницистов и эпидемиологов, не превышает 0,5%.
Таким образом, научные достижения последних
лет кардинально изменили требования к диагностике и выбору метода лечения
больных эхинококкозом. Новые аспекты морфологии паразита показали, что
результатом применения современных высокоинформативных инструментальных методов
исследования является не просто констатация факта наличия кисты, но и обязательное
указание в протоколе исследования ее характеристик: размер, характер
содержимого кисты, ее форма и форма дочерних кист, наличие экзо- и эндогенно
почкующихся кист, степень их проникновения в фиброзную капсулу. Наиболее
эффективными в этом плане признаны УЗИ и МРТ. Больные эхинококкозом, независимо
от размеров и локализации кист, не подлежат динамическому наблюдению и должны
быть направлены в хирургический стационар. Неоспоримо и то, что устарели
количественные показатели (размер кисты, толщина и уровень кальциноза
фиброзной капсулы и т.д.), традиционно используемые для определения метода
оперативного лечения. Только качественная характеристика паразита позволяет
выбрать оптимальную хирургическую технологию.
Методом выбора в лечении больных эхинококкозом
следует считать миниинвазивные вмешательства. Традиционные методы вмешательства
(перицистэктомии, резекции) целесообразны лишь при выявлении экзогенной пролиферации
кист, массивном кальцинозе фиброзной капсулы и должны находить ограниченное
применение. Хотелось бы особо подчеркнуть, что многочисленные сборные
статистики ведущих авторов, в том числе с анализом более 20 000 больных, свидетельствуют
о том, что результаты лечения больных эхинококкозом печени практически сходны
как при простой эхинококкэктомии без удаления фиброзной капсулы, так и при обязательном
ее удалении (перицистэктомии, резекции печени) при несравнимо большей травматичности
(выраженности хирургического стресса) последних вмешательств.
Еще более весомо звучит тезис о сужении
показаний к расширенным травматичным вмешательствам с внедрением комплексного
подхода, включающего применение послеоперационной противогельминтной терапии.
Опыт ведущих отечественных и зарубежных клиник
свидетельствует о том, что неукоснительное соблюдение отмеченных выше требований
позволяет, уменьшая хирургическую “агрессию”, добиваться хороших отдаленных результатов
с минимальным риском рецидива (не превышает 1%). Это подтверждает и опыт нашей клиники.
Отступление же от современного протокола ведения этой категории пациентов неизбежно
приводит к увеличению числа так называемых рецидивов заболевания. В лечении
этого тяжелого заболевания каждый хирург должен иметь выбор, а пациент рассчитывать
на индивидуальный подход.
Список литературы
1. Von Sinner W.N., Nyman R., Linjawi T., Ali A.M. Fine needle
aspiration biopsy of hydatid cysts // Acta Radiol. 1995. V. 36. N 2. Р. 168–172.
2. Guidelines for treatment of cystic and alveolar echinococcosis in
humans. Who Informal Working Group on Echinococcosis //Bull World Health Organ.
1996.
V. 74. Р. 231–242.
3. Дадвани С.А., Лотов А.Н., Мусаев
Г.Х. и др. Малоинвазивные технологии в абдоминальной хирургии: Клиническое
руководство по ультразвуковой диагностике/Под ред.В.В. Митькова. Т. 4. М.,
1997. 450 с.
4. Дадвани С.А., Шкроб О.С., Лотов
А.Н., Мусаев Г.Х. Комплексное лечение гидатидозного эхинококкоза//Факультетская
хирургическая клиника на пороге третьего тысячелетия. М., 2000. С. 315–322.
5. Мусаев Г.Х. Диагностика и
комплексное лечение гидатидозного эхинококкоза//Автореф. дис. … док. мед.
наук.М., 2000. С. 42.
6. Ветшев П.С. Абсцессы и кисты
печени // В кн: Болезни печени и желчевыводящих путей /Под ред. акад. В.Т. Ивашкина).
М.: М_Вести, 2005. С. 414–430.
7. Коваленко Ф.П. Экспериментальные модели эхинококкозов: оптимизация и применение в разработке новых методов диагностики, профилактики и лечения эхинококкозов человека и животных //Автореф. дис. … док. мед. наук. М., 1998.
